CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受體T細胞免疫療法。該療法是一種出現了很多年但近幾年才被改良使用到臨床中的新型細胞療法。
在急性白血病和非霍奇金淋巴瘤的治療上有著顯著的療效,被認為是最有前景的腫瘤治療方式之一。正如所有的技術一樣,CAR-T技術也經歷一個漫長的演化過程,正是在這一系列的演化過程中,CAR-T技術逐漸走向成熟。
這種新的治療策略的關鍵之處在于識別靶細胞的被稱作嵌合抗原受體(chimeric antigen receptor, CAR)的人工受體,而且在經過基因修飾后,病人T細胞能夠表達這種CAR。在人體臨床試驗中,科學家們通過一種類似透析的過程提取出病人體內的一些T細胞,然后在實驗室對它們進行基因修飾,將編碼這種CAR的基因導入,這樣這些T細胞就能夠表達這種新的受體。這些經過基因修飾的T細胞在實驗室進行增殖,隨后將它們灌注回病人體內。這些T細胞利用它們表達的CAR受體結合到靶細胞表面上的分子,而這種結合觸發一種內部信號產生,接著這種內部信號如此強效地激活這些T細胞以至于它們快速地摧毀靶細胞。
近年來,CAR-T免疫療法除了被用來治療急性白血病和非霍奇金淋巴瘤之外,經改進后,也被用來治療實體瘤、自身免疫疾病、HIV感染和移植排斥等疾病,具有更廣闊的應用空間。基于此,針對CAR-T細胞療法取得的最新進展,小編進行一番盤點,以饗讀者。
1.CAR T療法新突破!Nat Med背靠背發表兩個研究團隊發現避免細胞因子風暴的新方法
doi:10.1038/s41591-018-0041-7; doi:10.1038/s41591-018-0036-4
兩個來自美國和意大利的研究團隊分別提出了避免CAR T細胞療法治療白血病患者過程中出現細胞因子風暴(CRS)的新方法。在第一項研究中,來自紐約紀念斯隆凱特琳癌癥中心的研究人員發展了一種小鼠模型模擬發生CRS的情況,他們找到了涉及這種副作用的關鍵分子,并成功找到一種藥物抑制CRS;第二個研究團隊則使用不同的動物模型發現了同樣的分子,但是他們沒有抑制這個分子,取而代之的是對T細胞進行遺傳學修飾,從源頭防止了這種情況的發生。兩項研究成果于近日背靠背發表在《Nature Medicine》上。
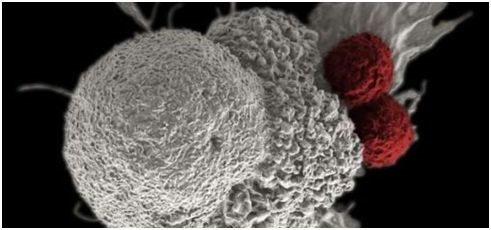
為了治療白血病,科學家們已經開發出了給病人來源的T細胞修飾上嵌合抗原受體(CAR)后再進行回輸的技術,也叫作過繼細胞轉輸,這整個過程叫做CAR T細胞療法,已經被證明可以非常有效的治療白血病。但是其使用面臨著一個主要的障礙——幾乎1/3的病人會發生CRS,這需要極其精細的個性化治療才能避免病人死亡。一些病人還產生了神經毒性。這些綜合征限制了這項技術的使用。而在這兩項最新研究中,研究人員找到了克服這些問題的新方法。
在第一項研究中,研究人員在創建動物模型之后,他們發現IL-1是導致CRS的關鍵因子——而過去的研究已經表明這個分子參與炎癥的發生,進一步研究則幫助研究人員發現一種叫做阿那白滯素的藥物可以抑制這個分子。在第二項研究中,研究人員發現了相同的的分子,他們給CAR T細胞添加了一個抑制基因以防止CRS產生。
2.Haematologica:首次!無需預先化療,新型CAR T療法治愈急性髓性白血病!
doi:10.3324/haematol.2017.186742
嵌合抗原受體T細胞療法(簡稱CAR T療法)被美國臨床腫瘤學會評為2017年最大的研究突破。這種個性化基因療法使用病人自身的免疫細胞對抗癌癥。目前FDA已經批準了CAR T細胞療法產品治療彌散性大B細胞淋巴瘤成年患者以及急性成淋巴細胞性白血病兒童和年輕成年人患者。現在莫菲特癌癥研究中心的研究人員正在將這項革命性的療法擴展到其他癌癥。
一種可能獲益的疾病是急性髓性白血病(AML),這是成年人最常見的急性白血病。超過一半的AML患者在化療后會消退。但是也有很多患者殘余的癌細胞可以耐受化療并躲過免疫系統,因此會復發。一項新的1期臨床試驗(THerapeutic Immunotherapy with NKG2D,THINK)正在研究Celyad公司的新型CAR T療法(CYAD-01,對免疫細胞進行基因工程化修飾使之表達天然殺傷細胞受體)靶向白血病的療效。
根據一項最新發表在《Haematologica》上的案例研究,一個病人在接受CAD-01治療后再進行骨髓移植,9個月之后仍然沒有復發的跡象。
3.Cancer Immunol Res:CAR T細胞療法成功清除小鼠轉移性結直腸癌
doi:10.1158/2326-6066.CIR-16-0362
在一項最新研究中,來自美國賓夕法尼亞州費城托馬斯杰斐遜大學的科學家們在藥理學與實驗治療學系Adam E. Snook博士的帶領下使用人類特異性的GUCY2C導向的單鏈可變區作為靶向人類表達GUCY2C的轉移灶的CAR的構成基礎。研究人員通過檢測活化標記物上調、細胞因子分泌和在體外對表達GUCY2C(而非GUCY2C缺陷)的癌細胞的殺傷表明靶向人GUCY2C的鼠源CAR T細胞可以促進抗原特異性的T細胞激活。
在同源小鼠模型中,研究人員發現GUCY2C CAR T細胞可以長期保護小鼠發生結直腸癌的肺部轉移。GUCY2C CAR T細胞可以識別并殺傷外源表達GUCY2C的人類結直腸癌細胞,使移植了人類腫瘤的免疫缺陷小鼠長期存活。
總體而言,研究人員在本研究中找到了一種人類GUCY2C特異性的CAR T細胞療法,或許可以發展成為治療表達GUCY2C的轉移性結直腸癌的有效療法。
4.Nat Med:CAR T療法新進展,Carl J領銜發現決定CAR T療效的生物標記物
doi:10.1038/s41591-018-0010-1
對自身抗原的耐受導致了人體免疫系統無法清除腫瘤細胞。為了克服這種免疫耐受并使腫瘤消退,來自賓夕法尼亞大學病理學和實驗學醫學部、細胞免疫治療中心的研究人員設計了一種嵌合抗原受體(CARs)治療慢性淋巴細胞白血病(CLL)病人。他們發現有部分病人的腫瘤消退了,但是大多數病人并沒有響應。
圖片來源:Penn Medicine
而此前并沒有研究對病人來源的CAR T細胞進行綜合分析以判斷治療成功或者失敗的機理。為此,研究人員進行了基因組學、表型和功能評估找到了決定治療成功與否的決定因素,相關研究成果于近日發表在《Nature Medicine》上,研究通訊作者為J. Joseph Melenhorst教授,腫瘤細胞免疫治療先驅Carl H. June參與了該研究。
轉錄組學分析顯示完全響應的病人體內的CAR T細胞富含記憶相關基因,包括IL-6/STAT3信號,而無響應的病人體內的CAR T細胞中涉及效應細胞分化、糖酵解、耗竭和凋亡的信號出現了上調。
持續的腫瘤消退與CAR T細胞產生之前CD27+CD45RO–CD8+ T細胞數量升高相關,這些細胞具有記憶樣細胞的特性。來自病人的這些高度功能化的CAR T細胞會產生STAT3相關的細胞因子,而血清中的IL-6與CAR T細胞增殖有關。抑制IL-6/STAT3可以消除CAR T細胞的增殖。
研究人員進一步進行了機理研究,他們發現高表達IL-6受體的CD27+PD-1–CD8+ CAR T細胞意味著治療有效,也正是這群細胞負責控制了腫瘤的進展。
(生物谷 Bioon.com)
